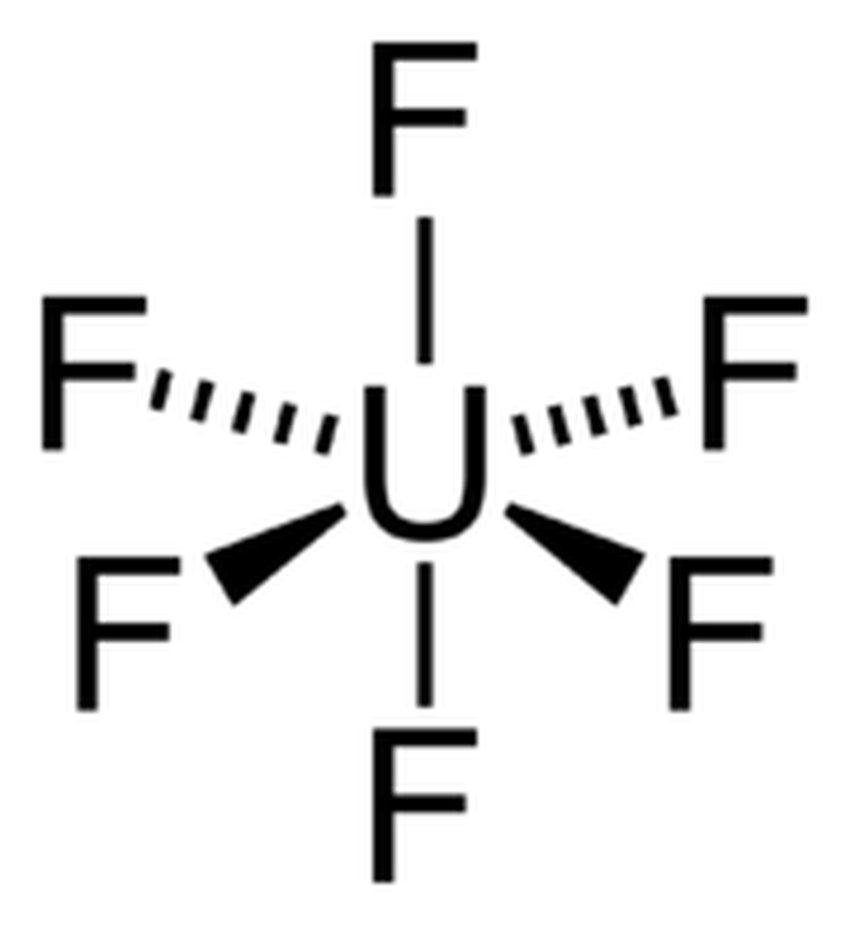
L'esafluorofosfato di litio è un composto ionico del catione litio con l'anione esafluorofosfato (PF6−), che si forma dalla complessazione di uno ione fluoruro (F−) con il pentafluoruro di fosforo (PF5), un forte acido di Lewis, sebbene meno di AsF5, e questo di SbF5.
La sua formula minima è quindi LiPF6. Per evidenziare gli ioni e le loro cariche viene meglio rappresentato come Li [PF6]−. Formalmente è anche il sale di litio dell'acido esafluorofosforico HPF6, acido che però è instabile in assenza di acqua.
Proprietà
A temperatura ambiente si presenta come una polvere cristallina incolore, o bianca se in forma finemente suddivisa, inodore e igroscopica. In acqua si scioglie, ma subisce idrolisi; l'infiltrazione di umidità nei solventi organici usati nelle batterie al litio può rappresentare un problema per sistemi che impiegano LiPF6.
L'esafluorofosfato di litio cristallizza nel sistema cubico, gruppo spaziale Fm3m, con una unità formula nella cella elementare e può essere considerato isostrutturale con NaPF6 e KPF6.
Da esperimenti di termogravimetria risulta che in campioni rigorosamente anidri LiPF6 mostra decomposizione termica a 134,84 °C, mentre in campioni commerciali questa inizia già a 114,5 °C.
È un composto tossico, corrosivo, dannoso per le mucose, pericoloso se ingerito, inalato o assorbito attraverso la cute.
Preparazione e applicazioni
L'esafluorofosfato di litio anidro, con purezza raggiungibile del 99,98% e adatto per batterie al litio, può essere preparato facendo reagire fluoruro di litio e pentafluoruro di fosforo (a sua volta preparato a parte da fluoruro di calcio e anidride fosforica) in acetonitrile come solvente a temperatura ambiente (20-30 °C) per 4 ore:
LiF PF5 → PF6
Le soluzioni di esafluorofosfato di litio in miscele di diesteri dell'acido carbonico (carbonati dialchilici o carbonati di alchilene), quali etilencarbonato, dimetil carbonato, dietil carbonato e/o etilmetil carbonato, in presenza di una piccola quantità di altri come additivi (fluoroetilen carbonato e vinilen carbonato) fungono da soluzioni elettrolitiche di elezione per le batterie agli ioni di litio. Questa applicazione sfrutta anche l'inerzia dell'anione esafluorofosfato verso agenti riducenti forti, come il litio metallico.
Reattività
Il sale è relativamente stabile termicamente, ma perde il 50% in peso a 200 °C. Si idrolizza vicino a 70 °C formando acido fluoridrico (HF) altamente tossico:
A causa dell'acidità di Lewis degli ioni Li , LiPF6 catalizza anche la tetraidropiranilazione degli alcoli terziari.
Nelle batterie agli ioni di litio, LiPF6 reagisce con Li2CO3, reazione che può essere catalizzata da piccole quantità di HF:
Note
Voci correlate
- Tetrafluoborato di litio